Les Universités Ben Gourion du Néguev et du Colorado mettent au point un anti-inflammatoire intelligent

[:fr]
Lorsqu’un agent pathogène entre en contact avec nos tissus cellulaires, certaines cellules résidant dans ces tissus détectent le pathogène (cellules dendritiques, mastocytes, macrophages, granulocytes). Ces cellules sont responsables de son immobilisation tandis que d’autres secrètent des médiateurs chimiques de l’inflammation (cytokines pro inflammatoires, histamines, prostaglandine). Chacun de ses médiateurs possède un rôle défini : augmentation de la perméabilité vasculaire, de la vasodilatation, de la douleur, etc. La famille des cytokines pro inflammatoires, et notamment l’interleukine 1 (IL1), a comme rôle de recruter de nouveaux médiateurs inflammatoires et donc de stimuler la réaction inflammatoire.
Les anti-inflammatoires
Les anti-inflammatoires en vente libre en pharmacie que l’on connaît bien (corticoïdes et anti-inflammatoires non-stéroidiens) procèdent généralement au blocage de la cascade de réactions aboutissant aux symptômes du mécanisme inflammatoire : fièvre, agrégation de plaquettes sanguines, douleurs, etc.
Le défaut de ces anti-inflammatoires résulte en leurs non spécificités. En effet, un anti-inflammatoire agit sur tout le corps, incluant les sites où un processus d’inflammation se déroule normalement, pour le maintien de l’homéostasie. Un de ces effets secondaires provient de la diminution de la capacité du système immunitaire à combattre les infections.
Les anti-inflammatoires spécifiques
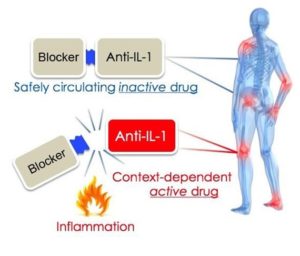
Les chercheurs de BGU et de l’université du Colorado ont cherché un remède à la non spécificité des anti-inflammatoires. Ils ont développé un médicament dit « intelligent » qui cible spécifiquement les sites d’inflammation. Pour ce faire, ils se sont basés sur un processus biologique naturel de l’inflammation. Les protéines cytokines IL1 possèdent plusieurs domaines : un domaine qui maintient la partie active de la cytokine non active, et la partie active de la cytokine. Lorsque que cette protéine rencontre certaines enzymes de l’inflammation, elle se fait cliver et la partie active est libérée.
Le Dr. Rider, le Dr. Lewis et le Pr. Dinarello ont développé une molécule semblable mais dont la partie active agit comme un inhibiteur de cytokines. Lorsque cette molécule rencontre ces enzymes, la molécule est clivée et la partie fonctionnelle inhibant les cytokines (donc le recrutement de médiateurs chimiques de l’inflammation) devient active.
Ce mécanisme d’action spécifique permettrait de réduire les effets secondaires des anti inflammatoires dont l’exposition à des infections opportunistes sur des sites éloignés. Risque qui est encouru particulièrement par les patients immunosuppressifs, les patients âgés et les patients soumis à des traitements anticancéreux.
L’action de cette molécule a été testée chez des souris porteuses d’une inflammation spécifique. Les résultats démontrent que la protéine chimérique est effectivement active au niveau du site infecté et induit une diminution locale de l’inflammation. L’activation de la protéine est corrélée positivement à la quantité de stimuli inflammatoire.
Ces résultats significativement concluants ont donné lieu au brevetage de la protéine chimérique par la compagnie de transfert technologique de l’université Ben Gourion ainsi que par l’université du Colorado. Une fois de plus une équipe de recherche Israélienne excelle dans le « continuum vertueux » entre recherche fondamentale et application. Voilà qui est prometteur…
Auteurs : Amaranta Kahn, Volontaire internationale chercheuse à l’Institut Weizmann
Angélique Toulon, chargée de mission scientifique et universitaire
Publication dans The journal of immunology, 15 juin 2015
Source BVST Israël[:en]Ben-Gurion University of the Negev (BGU) and University of Colorado researchers have developed a dynamic “smart” drug that targets inflammation in a site-specific manner and could enhance the body’s natural ability to fight infection and reduce side effects.
The uniqueness of this novel anti-inflammatory molecule, reported in the current issue of Journal of Immunology, can be found in a singular property. When injected, it is as a non-active drug. However, a localized site with excessive inflammation will activate it. Most other anti-inflammatory agents effectively inhibit inflammatory processes, though in a non-specific manner and in areas that include sites of necessary normal inflammatory homeostasis.
“This development is important because inhibition of inflammation in a non-specific manner reduces the natural ability to fight infections and is a common side effect of anti-inflammatory biologic therapeutics,” says Dr. Peleg Rider of BGU’s Department of Clinical Biochemistry and Pharmacology.
When a non-specific agent is used, any patient who suffers from local inflammation might then be exposed to opportunistic infections at distant sites, such as lungs, risking, for example, tuberculosis. This risk is mainly of concern to immunosuppressed patients, as well as older patients and patients undergoing chemotherapy as part of an anti-cancer treatment course.
“The beauty of this invention lies in the use of a known natural biological code,” Dr. Rider explains. “We mimicked a natural process that occurs during inflammation.”
The protein molecule is actually a chimera comprised of two domains, both originating from the potent inflammatory cytokine family of IL-1. The first part of the protein holds the functional part of the molecule inactive, as occurs in normal living cells, and is connected to a potent natural inhibitor of IL-1. When it encounters inflammatory enzymes, the molecule is cleaved and the functional part becomes active.
 Dr. Rider, along with BGU’s Dr. Eli Lewis and Prof. Charles Dinarello of the University of Colorado, demonstrated their findings in a mouse model of local inflammation. They showed that leukocytes, which infiltrate inflammatory sites, indeed activate the chimeric protein, which in turn reduces local inflammation. The activation of the protein correlated with the amount of inflammatory stimuli.
Dr. Rider, along with BGU’s Dr. Eli Lewis and Prof. Charles Dinarello of the University of Colorado, demonstrated their findings in a mouse model of local inflammation. They showed that leukocytes, which infiltrate inflammatory sites, indeed activate the chimeric protein, which in turn reduces local inflammation. The activation of the protein correlated with the amount of inflammatory stimuli.
“Thus, a point that is highly relevant to clinical practice arises. Upon resolution of inflammation, the activation of the protein is also reduced and side effects are avoided,” Dr. Rider explains.
The new chimeric molecule was patented by BGN Technologies, BGU’s technology transfer company, and by the University of Colorado.
The research was supported by the Kamin program of Israel’s Ministry of Economy’s Chief Scientist’s Office.
Publication in The journal of immunology, June 15th 2015[:]







