Université de Tel Aviv : le système nerveux peut transmettre des souvenirs aux futures générations

[:fr]
Selon une étude réalisée dans le laboratoire du Prof. Oded Rechavi de l’École de neurobiologie, biochimie et biophysique et de l’Ecole des neurosciences de l’Université de Tel-Aviv, par les doctorants Rachel Posner et Itai Toker, les souvenirs enregistrés par les cellules nerveuses peuvent être transmis aux générations suivantes par des molécules de transport du matériel héréditaire de type « petits ARN », sans passer par l’ADN.
Selon les chercheurs, « l’étude constitue un pas important dans le déchiffrement des mécanismes de l’épigénétique, transmission héréditaires de caractéristiques acquises qui ne sont pas codées dans notre ADN ».
« Les caractéristiques acquises au cours de la vie peuvent-elles être héritées par les prochaines générations ? C’est une question controversée depuis près de 200 ans parmi les scientifiques. À ce jour, l’un des organismes les plus couramment utilisé pour les études sur ce sujet est un minuscule ver transparent appelé C. elegans. Pas moins de six prix Nobel ont été attribués pour des études sur ce ver depuis l’année 2000″, explique Oded Rechavi.
Famine, résistance aux virus : l’hérédité ne passe pas seulement par l’ADN
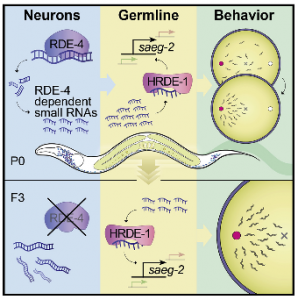 Précédemment, le Prof. Rechavi et son équipe avaient découvert que ces vers pouvaient transmettre à leur progéniture, sur plusieurs générations, au moins deux traits acquis au cours de leur vie : la résistance aux virus et la mémoire de la famine. Cela signifie que, contrairement à la conception qui domine depuis des décennies, l’hérédité ne passe pas seulement par le biais de l’ADN, mais aussi par d’autres mécanismes génétiques capables de transférer à la progéniture des traits acquis au cours de la vie.
Précédemment, le Prof. Rechavi et son équipe avaient découvert que ces vers pouvaient transmettre à leur progéniture, sur plusieurs générations, au moins deux traits acquis au cours de leur vie : la résistance aux virus et la mémoire de la famine. Cela signifie que, contrairement à la conception qui domine depuis des décennies, l’hérédité ne passe pas seulement par le biais de l’ADN, mais aussi par d’autres mécanismes génétiques capables de transférer à la progéniture des traits acquis au cours de la vie.
« Nous avons constaté que la résistance aux virus et la mémoire de l’état nutritionnel des parents sont transmises à la descendance par le biais de l’ARN, ou plutôt par de petites molécules d’ARN capables de migrer et de transférer des informations héréditaires de cellule en cellule. Le rôle de ces molécules est de faire s’exprimer les gènes de l’ADN correctement et au bon endroit du corps. Grâce à elles par exemple, bien que le code de l’ADN soit identique dans toutes les cellules, l’œil possède des gènes visuels et le genou d’autres gènes qui sont responsables de son fonctionnement spécifique », déclare le Prof. Rechavi.
Les chercheurs ont cherché à déterminer si la mémoire encodée tout au long de la vie dans les neurones du cerveau pouvait être transmise aux générations futures à l’aide de ces petites molécules d’ARN. À cette fin, ils ont créé des vers qui ne produisaient pas un certain type d’ARN appelés endo-siRNA, cette déficience les rendant incapables, entre autres, de trouver leur nourriture en se servant de leur odorat. Ils ont ensuite rendu au seul système nerveux de ces vers la faculté de produire ces endo-siARN, et les vers ont effectivement récupéré leur capacité de localiser de la nourriture. Les chercheurs ont également constaté que les molécules d’endo-siARN produits dans les cellules nerveuses atteignaient aussi d’autres tissus du corps chez le ver et y affectaient également l’expression génique.
Le petit pois de l’hérédité épigénétique
Restait à vérifier si les molécules d’endo-ARNs produites par le système nerveux de ces vers, était capables de passer vers les cellules sexuelles, et de là aux générations futures ? « La réponse fournie par l’étude a été positive. La progéniture de ces vers, dont l’ADN ne produisait pas cette molécule, a hérité cette caractéristique de leurs parents par hérédité et a su identifier les aliments par leur odeur et s’en rapprocher », répond le Prof. Rechavi.
Le Prof. Rehavi ajoute : « L’hérédité qui ne passe pas par les changements de séquences de l’ADN s’appelle l’épigénétique, domaine qui prend une grande ampleur dans la recherche ces dernières années. Dans notre étude nous avons franchi un nouveau pas important vers une compréhension approfondie des processus et des mécanismes de cette forme d’hérédité. Nous ne savons pas encore si le processus que nous avons découvert se produit également chez l’homme, mais si c’était le cas, toutes nos découvertes pourraient avoir des implications de grande portée. Il y a plus de cent ans, les scientifiques ont découvert le fonctionnement de l’hérédité génétique par l’ADN grâce à une étude sur les petits pois et sur les mouches. Nous espérons que le ver sur lequel nous travaillons sera le petit pois de l’hérédité épigénétique ».
Publication dans Cell, 6 juin 2019
Auteur : Sivan Cohen-Wiesenfeld, PhD, Rédac’chef de la newsletter des Amis français de l’Université de Tel Aviv
[:en]
Nematodes, worms found in virtually all environmental habitats, are among the most studied model organisms. They reproduce quickly and their genome contains nearly the same number of genes as the human genome.
A new Tel Aviv University study finds a mechanism exhibited in nematodes allows the nervous system cells — neurons — to communicate with germ cells, the cells that contain the information (genetic and epigenetic) that is transmitted to future generations. The research identifies the mode by which neurons transmit messages to these future generations.
« The mechanism is controlled by small RNA molecules, which regulate gene expression, » says Prof. Rechavi. « We found that small RNAs convey information derived from neurons to the progeny and influence a variety of physiological processes, including the food-seeking behavior of the progeny.
 « These findings go against one of the most basic dogmas in modern biology. It was long thought that brain activity could have absolutely no impact on the fate of the progeny. The Weismann Barrier, also known as the Second Law of Biology, states that inherited information in the germline is supposed to be isolated from environmental influences. »
« These findings go against one of the most basic dogmas in modern biology. It was long thought that brain activity could have absolutely no impact on the fate of the progeny. The Weismann Barrier, also known as the Second Law of Biology, states that inherited information in the germline is supposed to be isolated from environmental influences. »
According to the study, co-authored by Prof. Rechavi’s students Rachel Posner and Itai A. Toker, this is the first time a mechanism has been identified that can transmit neuronal responses across generations. The discovery may have major implications for our understanding of heredity and of evolution.
« In the past, we’ve found that small RNAs in worms can produce transgenerational changes, but the discovery of a transgenerational transfer of information from the nervous system is a Holy Grail, » explains Toker. « The nervous system is unique in its ability to integrate responses about the environment as well as bodily responses. The idea that it could also control the fate of an organism’s progeny is stunning. »
« We discovered that synthesis of small RNAs in neurons is needed for the worm to efficiently be attracted to odors associated with essential nutrients — to look for food. The small RNAs produced in the parents’ nervous system influenced this behavior, as well as the expression of many germline genes that persisted through at least three generations, » explains Prof. Rechavi.
In other words, nematodes that did not create the small RNAs exhibited defective food identification skills. When the researchers restored the ability to produce small RNAs in neurons, the nematodes moved toward food efficiently once again. This effect was maintained for multiple generations even though the progeny did not have the ability to produce small RNAs themselves.
« It’s important to stress that we don’t know yet whether any of this translates to humans, » Prof. Rechavi concludes. « If it does, then studying the mechanism could have a practical use in medicine. Many diseases might have some epigenetically inherited component. Deeper understanding of nonconventional forms of inheritance would be crucial to better understand these conditions and to design better diagnostics and therapies. »
« It would be fascinating to see if specific neuronal activities can impact the inherited information in a way that would give specific advantages to the progeny, » Toker adds. « Through this route, parents could potentially transmit information that would be beneficial to the progeny in the context of natural selection. It could therefore potentially influence an organism’s evolutionary course. »
The study was led by Prof. Oded Rechavi of TAU’s George S. Wise Faculty of Life Sciences and Sagol School of Neuroscience
Published in Cell on June 6, 2019
[:]







